Notes de séquence sur la cinétique chimique
Mise en situation
Observez les phénomènes représentés dans les images ci-dessous [1-2].
Décrivez le maximum d’aspects de ces phénomènes et essayez d’identifier des points qui leur sont communs. Notez que la réaction qui se produit dans un cristallisoir est celle du sodium métallique avec l’eau.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Planning de la séquence (Suggestion)
La séquence pourrait se dérouler comme suit:
- Cours 1
- En classe :
- De la page 1 jusqu’à la page 7
- Modélisation de résultats expérimentaux (annexe 1)
- En devoir :
- Test 1 en ligne
- Le graphique et les questions de pages 8 et 9 (annexe 2)
- En classe :
- Cours 2
- En classe :
- De la page 8 jusqu’à la page 14
- En devoir :
- Test 2 en ligne
- En classe :
- Cours 3
- En classe :
- Page 15 jusqu’à la page 18
- Exercices 1, 2 et 3
- En devoir :
- Test 3 en ligne
- Exercices 4 et 5 (annexe 3)
- En classe :
I. Principe de conservation de l’énergie
I.1 Système et environnement
Un système est une portion de l’espace à laquelle on s’intéresse et au sein de laquelle une transformation peut s’effectuer.
L’environnement est constitué de ce qui est extérieur au système. L’environnement, encore appelé le milieu extérieur, comprend tous les objets qui peuvent, mais ne doivent pas nécessairement, échanger de l’énergie et de la matière avec le système : il peut s’agir du récipient, du solvant dans lequel a lieu une transformation chimique, de l’air environnant etc.
On distingue trois types de systèmes : les systèmes ouverts, les systèmes fermés et les systèmes isolés.
Analysez les trois situations décrites dans le tableau ci-dessous.
- Identifiez dans chaque cas le système et l’environnement.
- Qu’est-ce qui distingue les trois systèmes ? Décrivez les différences entre ces systèmes et identifiez-les en tant que système isolé, fermé ou ouvert.

Nous allons maintenant analyser les propriétés de quelques systèmes courants pour voir s’ils peuvent ou non échanger de la matière et/ou de l’énergie.
- Dans lequel d’entre eux est-il possible d’échanger de la matière avec l’environnement ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
- Dans quel cas est-il possible d’échanger de l’énergie avec l’environnement ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
- Après avoir répondu aux questions a et b, classez ces systèmes en systèmes ouverts, fermés ou isolés.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
I.2 Premier principe de la thermodynamique
L’activité ci-dessous va vous permettre d’identifier les différentes formes d’énergie. Ce thème a déjà été étudié au cours de physique de 4e année (UAA3). Identifiez les formes d’énergie pour chaque type d’activité.

Conclusion :
- L’énergie peut se manifester sous différentes formes : mécanique, thermique, chimique, lumineuse. Notons qu’il n’y a pas que la lumière visible mais aussi d’autres radiations comme l’infrarouge, l’ultraviolet, les micro-ondes, les rayons X : de manière générale, on parle d’énergie radiative.
- L’énergie se transforme d’une forme en une autre forme.
- Si un système perd ou gagne de l’énergie, c’est parce qu’il y a un échange avec le milieu environnant.
- Pour un système isolé défini dans le paragraphe précédent, l’énergie totale à l’intérieur de celui-ci est constante. Cela ne signifie nullement qu’à l’intérieur du système l’énergie reste sans cesse sous la même forme : il peut y avoir des transformations, mais l’énergie totale du système ne varie pas.
| On peut énoncer comme suit le principe de conversation de l’énergie :« L’énergie totale d’un système isolé est constante »
Cela implique que si une partie du système isolé perd (ou gagne) de l’énergie, l’autre partie du système gagne (ou perd) une quantité équivalente d’énergie. |
II. Chaleur, température, énergie thermique et capacité calorifique
II.1 Chaleur, température et énergie thermique
Expérience a :
Matériel nécessaire : Bécher, plaque chauffante, thermomètre et glaçons
Déposez quelques glaçons avec un peu d’eau dans un bécher. Chauffez à présent ce contenu avec une plaque chauffante jusqu’à ce que toute la glace soit fondue. Mesurez la température tout au long du processus.
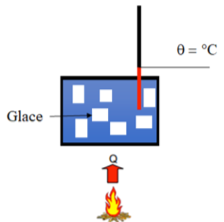
- Que peut-on dire de la température ?
………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
- Pourquoi la transformation de l’état d’agrégation de l’eau a-t-elle pu avoir lieu ?
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Expérience b :
Matériel nécessaire : Bécher, isolation thermique, plaque chauffante, thermomètre, éthanol et eau
Versez dans un premier bécher 58 mL (46 g, soit 1 mol) d’éthanol et versez dans un second bécher 18 mL (18g, soit 1 mol) d’eau. Les deux liquides sont à température ambiante (mesurez cette température dans les deux béchers). Isolez les parois et l’ouverture de chaque bécher par du polystyrène pour éviter les pertes thermiques. Chauffez les deux béchers avec le même système pendant un temps donné (3 minutes par exemple) puis mesurez la température des deux contenus.

Décrivez vos résultats expérimentaux et les réflexions qu’ils vous inspirent.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
| Cadre théoriqueQu’est-ce que la chaleur ?
Les atomes et les molécules d’une substance sont en agitation permanente. L’énergie associée à l’ensemble de ces mouvements s’appelle l’énergie thermique du système. Lorsque de l’énergie thermique est transférée d’un système à un autre, on donne à ce transfert le nom de chaleur. On note la chaleur par le symbole Q. Un système peut donc donner ou recevoir de la chaleur. Plus la quantité de matière d’un système est grande, plus ce système contient d’énergie thermique. L’énergie thermique d’un système dépend donc de la quantité de matière qu’il contient. L’énergie thermique et la chaleur s’expriment logiquement dans l’unité d’énergie, le Joule (J). Qu’est-ce que la température d’un système ? Pour définir la température, considérons l’énergie cinétique que possède, en moyenne, un atome ou une molécule du système considéré. Il faut bien dire « en moyenne » parce que l’énergie cinétique d’un atome ou d’une molécule change presque tout le temps à cause des chocs entre les molécules. La température absolue (exprimée en K )[4] est une grandeur proportionnelle à l’énergie cinétique moyenne par atome ou par molécule. Elle ne dépend pas de la taille du système. Si le système est à l’équilibre, la température est la même partout dans le système. Par contre, si on met en contact deux systèmes fermés qui n’ont pas la même température, de la chaleur va être transférée du système le plus chaud vers le système le plus froid jusqu’à ce que la température soit identique dans les deux systèmes. |
- Modélisation schématique du phénomène observé dans l’expérience a : à réaliser dans l’annexe 1
Interprétation de l’expérience a
- Modélisation du phénomène observé dans l’expérience b : à réaliser dans l’annexe 1
Interprétation de l’expérience b
|
|
II.2 Capacité calorifique
Analyse d’une expérience : Dans un bécher 1, on a versé 100 g d’eau et dans un autre, 200 g d’eau, à température ambiante. On a entouré les parois latérales et l’ouverture par du polystyrène pour éviter les pertes de chaleur. On a ensuite chauffé les deux béchers avec la même plaque chauffante pendant 6 min et mesuré les températures des deux béchers toutes les 20 secondes. La plaque fournit une quantité de chaleur constante par unité de temps. Le tableau ci-dessous indique les résultats des mesures de l’élévation de température, delta T = T-T0 est la température à l’instant initial, ainsi que la quantité de chaleur totale absorbée jusqu’à un temps donné. Cette quantité de chaleur fournie dépend du réglage de la plaque chauffante.
| t(s) | delta T(°C) 100g d’eau | delta T(°C) 200 g d’eau | Q(kJ) | t(s) | delta T(°C) 100g d’eau | delta T(°C) 200 g d’eau | Q(kJ) | |
| 0 | 0 | 0 | 0 | 180 | 4,5 | 2,3 | 1,93 | |
| 20 | 0,1 | 0 | 0,03 | 200 | 5,3 | 2,7 | 2,17 | |
| 40 | 0,3 | 0,1 | 0,12 | 220 | 6,1 | 3,1 | 2,43 | |
| 60 | 0,6 | 0,3 | 0,26 | 240 | 7,0 | 3,4 | 2,70 | |
| 80 | 1,0 | 0,4 | 0,43 | 260 | 7,8 | 3,9 | 2,91 | |
| 100 | 1,5 | 0,7 | 0,68 | 280 | 8,5 | 4,2 | 3,19 | |
| 120 | 2,2 | 1,0 | 1,01 | 300 | 9,1 | 4,6 | 3,45 | |
| 140 | 2,9 | 1,4 | 1,34 | 320 | 9,6 | 5,0 | 3,70 | |
| 160 | 3,7 | 1,9 | 1,70 | 340 | 10,1 | 5,4 | 3,97 | |
| 360 | 10,6 | 5,7 | 4,23 |
Portez sur le même graphique les valeurs de delta T(°C) pour 100 g et 200 g d’eau en fonction des valeurs de Q(kJ)

- Quel type de relation mathématique ce graphique suggère-t-il ?
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
- Calculez les pentes des deux droites.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
- Quelle équation mathématique entre delta T, Q et la quantité d’eau peut-on déduire?
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
La capacité calorifique massique (ou chaleur massique) c …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
La quantité de chaleur Q …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Test 1 – Approfondissement : à faire comme devoir pour …https://docs.google.com/forms/d/e/1FAIpQLSeWbUXreje23Y7fUMzhq0TqxfH9-WXDiJALAIPJwrGoyJ_UAA/viewform
III. Processus exothermique, endothermique et athermique
III.1 Accessoires indispensables pour des activités sportives
Vous programmez vos prochaines vacances sportives à la montagne. Vous faites une liste des achats nécessaires afin de préparer au mieux vos randonnées. En faisant quelques recherches sur internet, vous découvrez une publicité pour une soupe en conserve un peu particulière (utilisée en cas de petit creux). D’autre part, en cas de chute, une compresse refroidissante pourrait être indispensable.
En vous aidant des données ci-dessous, expliquez le fonctionnement des soupes auto-chauffantes ainsi que des compresses refroidissantes.

Comment pourriez-vous définir, au niveau énergétique, le phénomène exploité dans ces deux applications ?
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Transferts de chaleur dans les transformations physico-chimiques :

On peut définir 3 types de processus en fonction de l’échange d’énergie qui se produit :
- Processus exothermique (du grec : exo= hors de et thermos=chaud) : processus qui dégage de la chaleur
- Processus endothermique: processus qui absorbe de la chaleur
- Processus athermique: processus qui se fait sans échange de la chaleur
Si un processus est endothermique le processus inverse est nécessairement exothermique.

- Les processus suivant sont-ils endothermiques ou exothermiques ?
| Transformation | Endothermique | Exothermique |
| La cuisson d’un gâteau | ||
| La formation de la rosée | ||
| 2 NaNO3(aq) + Q -> 2 NaNO2(aq) + O2(g) | ||
| N2(g) + 3 H2(g) -> 2 NH3(g) + Q | ||
| C(s) + O2(g) -> CO2(g) + 394 kJ | ||
| La combustion du propane. | ||
| L’électrolyse de l’eau |
Test 2 – Approfondissement : à faire comme devoir pour …
https://docs.google.com/forms/d/e/1FAIpQLScTel1OD-B0Swq_nFBGtv3bA5FsQ90Y7Xsd20xbZEPZRXWEeQ/viewform
IV. Calorimétrie
Comment déterminer de façon précise la quantité de chaleur dégagée ou absorbée lors de ces processus chimiques ?
IV.1 Principe de la mesure calorimétrique
Au niveau de l’expérience que nous avons décrite pour introduire la notion de capacité calorifique massique, nous avons vu que la quantité de chaleur Q qu’il faut apporter à un corps de masse m et de capacité calorifique c pour élever sa température d’une valeur ?q se calcule par la formule :
Q = m . c . delta T
Un dispositif qui permet de mesurer la chaleur absorbée ou libérée lors d’une réaction chimique s’appelle un calorimètre. Dans les expériences de la partie II, nous avons pris soin d’isoler nos béchers avec du polystyrène pour éviter les pertes thermiques. Il va de soi que, si on veut mesurer la chaleur échangée lors une réaction chimique, il faut éviter que de la chaleur n’aille se perdre à l’extérieur de notre système réactionnel. L’isolation thermique est donc essentielle. En classe, nous utiliserons une version simplifiée de calorimètre qui est suffisante pour nos expériences (figure de gauche ci-dessous). Les chercheurs professionnels utilisent un système plus sophistiqué (figure de droite).
Dans le cas de notre calorimètre, on peut considérer qu’une quantité de chaleur Q sera transférée par le processus chimique à la solution ou est fournie par la solution au système chimique. Par conséquent, la masse de la solution constitue l’environnement.
Le système correspond aux réactifs, dans le cas d’une réaction, ou au composé à dissoudre, dans le cas d’une dissolution.
Nous pouvons écrire la relation suivante pour la quantité de chaleur Q donnée ou reçue par l’environnement (c’est-à-dire la solution) :
Q = c solution . m solution . delta T

IV.2 Application pratique
Quelle est la quantité de chaleur échangée lors de la dissolution de différents sels ?
| Matériel | Produits chimiques |
| Un calorimètreThermomètre au 1/10ème de °C | Eau déminéraliséeSubstances à dissoudre KNO3, NH4NO3, CaCl2, CaCl2.6H2O |
| Mode opératoire | |
| Par groupe de 3 vous allez réaliser une mesure avec une de quatre substances : – Tarer la balance avec le récipient intérieur du calorimètre
– Verser 100 g d’eau dans ce récipient. – Noter la température initiale de cette eau. – Peser 5 g de composé à tester – Verser ce composé dans votre dispositif – Refermer votre dispositif – Agiter pour assurer la dissolution – Relever la température finale de la solution obtenue |
|
| Questions | |
| A. Quelle est la quantité de chaleur échangée entre votre substance et l’environnement ?………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
B. Que pensez-vous qu’il se produirait si nous ajoutions 10 grammes de sel au lieu de 5 grammes ? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… |
|
En savoir plus:
Dans toutes les recettes de cuisine on indique à présent le « contenu énergétique » et il existe des tables avec ces contenus énergétiques pour une série d’aliments et de boissons. Vous pouvez consulter ce lien http://www.les-calories.fr/.
Nous remarquons qu’ils sont donnés dans l’unité kcal : 1 kcal= 4,18 kJ.
Mais comment ces contenus énergétiques ont-ils été déterminé ?
Pour en savoir plus, vous pouvez aller sur ce lien: https://drive.google.com/open?id=1q9smmw72rPfG6cxU8iVquHYICxxmDZvDCY27ZeAjYpU
V. Notion d’enthalpie et variation d’enthalpie
Dans les expériences réalisées, nous avons constaté qu’il y a des échanges d’énergie entre le système et l’environnement. Qu’est-ce qui fait que certaines transformations absorbent de l’énergie tandis que d’autre en dégagent ? Cela provient du fait que l’énergie interne des réactifs n’est pas la même que celle des produits.
En quoi consiste l’énergie interne d’un système chimique ?
Dans les transformations physiques et chimiques, l’énergie emmagasinée dans les molécules résulte
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
La notion d’enthalpie
| Les chimistes réalisent généralement leurs réactions dans des conditions où la pression extérieure reste constante.On montre en thermodynamique que la chaleur absorbée ou dégagée dans de telles conditions est égale à la variation d’une fonction que l’on appelle enthalpie et que l’on note H.
Qp = chaleur absorbée ou dégagée par le système à P constante = Hfinal– Hinitial =delta H H est en fait égal à l’énergie interne du système, notée U, à laquelle on ajoute le produit PV (Pression dans le système * Volume du système) H = U + PV L’enthalpie H est donc directement liée à l’énergie que possède le système chimique |
Unités d’enthalpie : puisque l’enthalpie est une quantité d’énergie, elle s’exprime donc en Joule (J).
L’enthalpie d’une mole de substance est appelée l’enthalpie molaire. Son unité est le Joule / mol (J/mol). On utilise aussi fréquemment le kJ/mol = 103 J/mol.
L’enthalpie des réactifs est notée HR.
L’enthalpie des produits est notée HP.
DH = HP – HR représente la variation d’enthalpie au cours de la transformation.
- Processus endothermique

- Processus exothermique

Nous devons encore relier la variation d’enthalpie d’une réaction, DH, que l’on nomme simplement l’enthalpie de réaction, à la chaleur mesurée dans un calorimètre.
Dans un calorimètre, on mesure la chaleur absorbée ou libérée par le milieu extérieur. Cette chaleur est l’opposé de celle libérée ou absorbée par le système. Par conséquent :
Application : A partir des résultats expérimentaux de la partie IV (Calorimétrie) déterminez l’enthalpie de dissolution (c’est-à-dire la variation d’enthalpie lors de la dissolution) des sels suivants dans l’eau : KNO3, NH4NO3, CaCl2, CaCl2.6H2O.
| Sel (5 g) | |||
| KNO3 | |||
| NH4NO3 | |||
| CaCl2 | |||
| CaCl2.6H2O |
Vous aviez travaillé avec 5 grammes de chaque sel. Le mesuré correspond donc à cette quantité de matière. Pour obtenir l’enthalpie molaire de dissolution, notée , il vous suffit de diviser le obtenu par la quantité de matière (en mol) contenue dans ces 5 grammes.
| Sel | Masse (g) | Quantité de matière n (mol) | ||
| KNO3 | 5,0 | |||
| NH4NO3 | 5,0 | |||
| CaCl2 | 5,0 | |||
| CaCl2.6H2O | 5,0 |
Test 3 – Approfondissement : à faire comme devoir pour …
https://docs.google.com/forms/d/e/1FAIpQLSdrdHEjSaneD-pBf2aR2TqOjKRZ2MQLCZ1pMGNUlF4-43OFkQ/viewform
[1] http://energie-developpement.blogspot.be/
[2] https://intra-science.anaisequey.com/chimie/201-exp-sodium-eau
[3] http://pccollege.fr/cinquieme-2/les-circuits-electriques-en-courant-continu/chapitre-i-le-circuit-electrique/
[4] Pour rappel : la température absolue notée T et exprimée en Kelvin (K) est reliée à la température q exprimée en °C par la relation T(K) = q (°C) + 273,15
[6] http://www.miamz.fr/tag/soupe-autochauffante/
[5] https://www.distribution-daki.com/rapid-relief
Annexe 1 Nom, prénom et classe ………………………..
Modélisez de manière schématique le phénomène observé
Pour l’expérience a
- Traduisez les changements macroscopiques par des symboles schématiques :
- Au niveau de l’état d’agrégation de l’eau
- Au niveau de la température
- Au niveau de l’échange de l’énergie avec le milieu extérieur (plaque chauffante)

Pour l’expérience b
Afin de mettre en évidence les observations de l’expérience b, choisissez la modélisation (a, b, c ou d) qui peut traduire correctement le changement macroscopique observé pour l’eau et pour l’éthanol.
La longueur des flèches représente l’énergie cinétique des molécules et la direction des flèches représente la direction du mouvement.

![]()
![]()




